Historique de Marseille
| liens |
le 18/08/17
| ��L’actualité du LAM | ��Le cours à l’Observatoire Historique de Marseille |
| �� Mis à jour le 18/08/17 |
||||
| �� Fiches : les hydrocarbures | |||||||
Ce texte n’a pas la prétention d’être un cours sur les hydrocarbures. Vous constaterez en le lisant que le sujet est vaste. Il s’agit seulement d’un aperçu destiné à comprendre sommairement la chimie qui se produit dans le milieu interstellaire et les nuages moléculaires, où se trouvent de très nombreuses molécules.
Les composés chimiques contenant du carbone sont les composés organiques. On en connait plus de 12 millions !
Parmi eux, les hydrocarbures sont des composés chimiques constitués uniquement de carbone et d’hydrogène. Ils donnent lieu à d’innombrables formules différentes. Les atomes d’hydrogène sont monovalents : ils possèdent une liaison. Par exemple, deux atomes d’hydrogène peuvent partager leurs liaisons pour former une molécule d’hydrogène H2 (formule brute, indiquant le nombre d’atome de chaque espèce chimique). On le symbolise aussi par H-H, formule développée dans laquelle le - représente la liaison partagée par les deux atomes d’hydrogène.
Les liaisons chimiques sont produites par des forces d’origine électrique (le noyau atomique étant chargé positivement, et le cortège électronique négativement). Ces forces donnent des liaisons plus ou moins fortes selon les atomes reliés. On en distingue de plusieurs natures. La plus simple est la liaison covalente, dans laquelle un électron est partagé par deux atomes.
L’énergie de liaison chimique est de l’ordre d’un électron-volt. Par comparaison, l’énergie de liaison des nucléons dans un noyau atomique est de l’ordre du million d’électrons-volt (MeV).
Deux atomes peuvent partager plus d’un électron. Selon le nombre d’électrons partagés, la liaison est simple (1), double (2), triple ou même quadruple.
Les atomes de carbone sont tétravalents : ils possèdent 4 liaisons et peuvent se lier à 4 autres atomes. Par exemple, un atome de carbone peut se lier à 4 atomes d’hydrogène. La formule brute de cet assemblage, nommé méthane, sera CH4, sa formule développée est plus difficile à écrire, car elle possède une forme dans le plan :
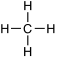
Dans certains composés, les atomes de carbone peuvent se lier les uns aux autres. Ils partageront alors une ou plusieurs liaisons. Si deux carbones présentent une double liaison, qui sera notée =, ils seront liés à deux hydrogènes de moins (pour chacun, un hydrogène est remplacé par l’autre carbone). La propriété pour un hydrocarbure d’avoir le maximum possible d’atomes d’hydrogène s’appelle saturation : ces composés sont les hydrocarbures saturés. On les nomme encore alcanes (les hydrocarbures sont nommé par le préfixe alc suivi de ane, ène ou yne). Le plus simple est le méthane dont on a donné les deux formules (brute et développée) plus haut.
Le second alcane (par ordre de complexité croissante) est l’éthane : C2 H6. Sa formule développée est :
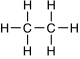
On voit qu’entre les deux carbones il y a une simple liaison. Cet hydrocarbure est lui aussi saturé. Le suivant, nommé propane, se définit en reproduisant le même motif :
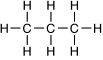
Sa formule brute est C3H8.
La formule brute générale qui représente toute cette famille des alcanes est Cn H2n+2.
Voici la liste des plus simples :
| Alcanes | |||
|---|---|---|---|
| nom | formule | nom | formule |
| méthane | CH4 | heptane | C7H16 |
| éthane | C2H6 | octane | C8H18 |
| propane | C3H8 | nonane | C9H20 |
| butane | C4H10 | décane | C10H22 |
| pentane | C5H12 | pentadécane | C15H32 |
| hexane | C6H14 | eicosane | C20H42 |
Remarquez l’octane. C’est un hydrocarbure qui ne s’enflamme pas spontanément lorsqu’il est chaud, contrairement à l’heptane. L’indice d’octane caractérise l’auto-inflammabilité d’un carburant, en donnant la proportion de ces deux hydrocabures qui se comporte de la même manière.
Les hydrocarbures qui comportent un groupe C=C (une double liaison), ne comportent pas le nombre maximum d’atomes d’hydrogène ; ils sont insaturés. On les nommait autrefois oléfines.
Pour être insaturé, un hydrocarbure doit donc comporter une double liaison entre deux carbones, donc au moins deux atomes de carbone. La double liaison entre eux ne leur laisse que deux liaisons à chacun pour se lier à des hydrogènes. Donc chaque carbone sera lié à deux hydrogènes : CH2 = CH2 (ou C2H4). Il s’agit de l’éthylène (éthylène est le nom courant, consacré par l’usage. Le nom qu’il faudrait utiliser est éthène, pour respecter les règles de formation des noms).
Remrque : l’alcool éthylique est construit sur l’éthylène, en subsituant à l’un des hydrogènes un radical hydroxyle OH. De même, l’alcool méthylique est construit sur la méthane.
Il y a toute une famille de tels hydrocarbures, qui sont nommés collectivement alcènes. Comme pour les alcanes, on peut ajouter un carbone, puis un autre… Après l’éthylène on obtient ainsi le propylène, comportant deux atomes de carbone. Avec trois atomes, on a le butylène… On remarque que les noms sont semblables à ceux des alcanes, en changeant le suffixe ane par cène.
Pour être le plus saturé possible, sans l’être complètement, un hydrocarbure doit comporter une double liaison, mais de simples liaisons avec les autres carbones. On obtient ainsi une famille de formule générale CnH2n.
A ce niveau, on imagine la possible existence d’hydrocarbures ayant plusieurs doubles liaisons. Plus il y a de doubles liaisons, moins il y a d’atomes d’hydrogène, plus faible est la saturation. Tout ceci donne donc une variété immense de molécules différentes. Si on considère en plus que chaque atome d’hydrogène peut être remplacé par un radical complexe, on aboutit à la chimie organique qui détermine la Vie.
On peut également avoir une triple liaison entre deux carbones, ce qui donnera lieu à une nouvelle famille d’hydrocarbures. On les appelle alcynes.
H-C ≡ C-H
C’est le plus simple ; il s’agit de l’acétylène (nom usuel), dont le nom standard est éthyne.
Par substitution d’un radical R quelconque, on obtient :
R-C ≡ C-H
On peut aussi substituer les deux hydrogènes :
R-C ≡ C-R'
On dit que l’on a affaire à un alcyne vrai si R ou R′ reste un hydrogène.
Les hydrocarbures aromatiques, contrairement aux précédents qui sont des chaînes linéaires, comportent un cycle de carbones. Ce cycle se nomme noyau benzénique. Il contient des doubles liaisons, et les aromatiques sont donc insaturés.
Le plus simple des hydrocarbures aromatiques est le benzène [C6H6] :
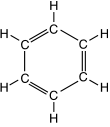
Avec deux cycles, on a le naphtalène [C10H8] (2 cycles accolés) et le biphényle [C12H20] (2 cycles liés par liaison simple). Dans les alkylbenzènes, on aura le toluène [C8H5-CH3].
Le noyau benzénique présente une symétrie. Il est entouré de 6 atomes d’hydrogène, auxquels on peut substituer des radicaux. Si on ne substitue qu’un seul hydrogène, on conserve la symétrie, et on a une molécule unique. Mais si on en substitue plusieurs, il y a plusieurs façons de le faire. Prenons un exemple simple, le chlorobenzène, obtenu en substituant un hydrogène par un atome de chlore. Sa formule brute est : C6H5Cl. C’est le mono-chlorobenzène.
Si on substitue deux hydrogènes par deux chlores, on obtient du di-chlorobenzène. Mais il y a trois façons différentes de placer les deux atomes de chlore, selon qu’ils sont consécutifs, ou séparés par un ou deux hydrogènes. S’ils étaient séparés par trois hydrogènes, on obtiendrait une molécule où les chlores sont séparés par DEUX hydrogènes, mais de l’autre côté du cycle.
Si les deux atomes sont consécutifs, c’est la position ortho ; s’il y a un hydrogène entre les deux, c’est la position méta ; s’il y en a trois, c’est la position para. Les molécules correspondantes sont l’ortho-di-chlorobenzène, le méta-di-chlorobenzène et le para-di-chlorobenzène.
On parle d’isomérie lorsque deux molécules possèdent la même formule brute alors que les atomes sont arrangés de façon différente. Des telles molécules sont dites isomères l’une de l’autre.
On distingue différents type d’isomérie : isomérie de chaîne, isomérie de fonction, isomérie de position, stéréoisomèrie
La classe des hydrocarbures, molécules ne contenant que du carbone et de l’hydrogène, est déjà très vaste. Elle comprend aussi les polymères, que l’on obtient en répétant un motif. Ainsi, l’éthylène comprend deux atomes de carbone, liés par une double liaison, et associés chacun à deux hydrogènes. La polymérisation rompt la double liaison de deux molécules d’éthylène, libérant une liaison pour chaque atome de carbone. Ces deux atomes se lient par cette liaison. Ainsi, le poyléthylène ne comprend-t-il pas de double liaison entre les carbones, ce qui devrait le ranger étymologiquement plutôt vers les alcanes. Mais sa formation par polymérisation justifie son nom.
La polymérisation donne de très nombreux composés, et l’industrie s’en sert énormément. Le résultat est une molécule très longue, linéaire. Mais des structures plus complexes, non linéaires, sont évidemment possibles.
Enfin, on peut aussi substituer dans toutes ces molécules, un atome (ou plusieurs) d’hydrogène par des radicaux contenant des atomes autres, comme le chlore, le sodium, le phosphore… L’immense variété des molécules que l’on obtient ainsi constitue la chimie organique.
Nous avons mentionné plus haut la substitution d’un radical OH à un atome d’hydrogène, qui donne un alcool. On a observé, dans les nuages moléculaires, des molécules d’alocool éthylique, ainsi que des molécules aromatiques. Tout ce qu’il faut pour produire certaines boissons à consommer avec modération !
---=OO=---